
MDR (EU) 2017/745法規第27條和IVDR (EU) 2017/746法規第24條均對UDI做出了規定:
01、UDI由UDI-DI(器械標識符)和UDI-PI(生產標識符)組成;
02、UDI 應使用于器械的標簽或其包裝上,或者可重復使用器械本身(直接標記);
03、經濟經營者,衛生機構和衛生保健人員分別根據本細則第8和9款規定的條件存儲UDI;
04、根據MDR第28條和IVDR第25條,為唯一器械標識建立UDI電子系統(“ UDI數據庫”),該數據庫是Eudamed數據庫的一部分;
UDI是什么?
UDI(Unique Device Identification)醫療器械唯一標識,是通過全球公認的器械標識和編碼標準創建的一系列數字、字母或字符。它可以明確地識別市場上的醫療器械。
UDI由UDI-DI(器械標識符)和UDI-PI(生產標識符)組成,它可以包括有關批號或序列號的信息,并且可以在世界任何地方使用。
UDI-DI是特定于某一制造商和器械的UDI器械標識符,提供附件VI 第B部分所述信息訪問途徑。
UDI-PI用于標識所生產的器械單元以及附錄VI 第C 部分中包裝后的器械(若適用)。
什么是Basic UDI-DI?
Basic UDI-DI是訪問Eudamed數據庫中器械相關信息時的關鍵詞,也是相關文檔[例如,證書(包括自由銷售證書),歐盟符合性聲明,技術文檔以及安全和(臨床)性能摘要)]中的關鍵信息。
它旨在識別和連接具有相同預期用途,風險等級以及基本設計和制造特征的器械。
它獨立于/獨立于器械的包裝/標簽,并且沒有出現在任何貿易商品上。
任何Basic UDI-DI均應以唯一的方式標識該Basic UDI-DI涵蓋的器械(組)。
區別
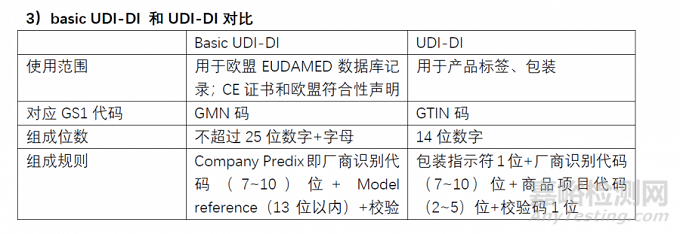
如何準備Basic DUI-DI
Basic UDI-DI是在醫療器械的一個器械組層面上分配DI并完成賦碼,這個和原來UDI-DI需要針對每一組別產品中的每個規格,每個包裝規格分別賦碼是不同的。
Basic UDI-DI是EUDAMED數據庫中關鍵信息,同時會體現在CE證書、歐盟符合性聲明和技術文件中。
Basic UDI-DI的結構
Basic UDI-DI是由Company Prefix + Model Reference+校驗碼組成,長度不能超過25位。
Company Prefix即廠商識別代碼,與UDI中的一致,由 GS1 分配
Model Reference,也就是產品識別代碼,是由企業自行編制, 可由字母和數字組成,比如口罩產品即可命名MASK001,或直接 MASK也可以。
校驗碼:直接在 GS1 網站輸入company prefix 和 Model Reference 信息,在線生成校驗碼檢驗網址:https://www.gs1.org/services/gmn-generator
結束語
歐盟的Basic UDI-DI是歐盟醫療器械法規中的一個概念,是器械類型的主要識別符,該代碼與UDI-DI不同。UDI-DI跟著產品走,體現在產品、包裝和標簽上,實現的是產品追溯目的;
而Basic UDI-DI跟著文件走,體現在證書、符合性聲明和技術文件中,實現的是文件對應的產品組的識別。
Basic UDI-DI的要求已經于2021年5月26日開始生效,廣大制造商需要盡快申請編碼并納入自身的MDR文件體系。
- 可靠性測試之老化測試 2024-12-29
- 切削油煙霧、粘附問題解決方案 2024-12-29
- 可靠性|定時截尾試驗裝備無失效被接收的MTBF估計 2024-12-29
- 中頻電療儀的研發試驗要求、相關標準與主要風險 2024-12-29
- 十二烷基硫酸鈉的新檢測指標 2024-12-29
- 紐扣電池澳洲發布強制性標準和供應商指南解讀 2024-12-29
- 壓力表計量檢定故障的解決措施 2024-12-29
- 光伏逆變器環境及EMC試驗要求 2024-12-29
- 我國人工智能醫療器械標準化加速推進 2024-12-29
- FDA:美敦力一級召回54997件未消毒血管造影導絲 2024-12-29
- 西班牙啟動“禁塑令”全球都在向塑料袋宣戰 2024-12-29
- 電子產品做FCC解讀的三種方式 2024-12-29
- SABER解讀范圍以及檢測項目流程 2024-12-29
- 家用電器CE解讀辦理檢測項目與流程 2024-12-29
- ISO27001信息安全管理體系標準解讀流程 2024-12-29
聯系方式
- 電 話:075523312011
- 業務:黃工
- 手 機:18002557723
- 微 信:18002557723






